近日,西安交通大学黄强团队、杜克大学沈西凌团队,以及麻省理工学院Rudolf Jaenisch团队通力合作,在《科学》杂志上发表重要研究报告。
他们开发了一种小鼠胚胎发育活体成像技术,通过不同发育阶段的“腹窗”,首次实现了高分辨成像观察小鼠胚胎第9.5天至出生的连续发育过程。
论文首页
研究团队利用这项新技术在转基因小鼠体内观察到了胚胎的神经递质传递、大脑形成早期神经嵴细胞分化成血管周细胞、视网膜发育过程中的细胞自噬、腺病毒递送、荧光化学药物在胎盘中的转运、细胞分裂和迁移,甚至还追踪了人神经嵴细胞和鼠神经嵴细胞在同一人鼠嵌合体中的嵌合差异。
有了这项技术之后,科学家终于可以像研究透明的斑马鱼一样观察哺乳动物的胚胎发育过程了。
在这里呢,我们得感谢下模式小鼠,它们为人类的健康付出了太多太多。
该图片由Free-Photos在Pixabay上发布
接下来我们就以文字、图片和视频的形式,给大家介绍下这项技术本身,以及它的厉害之处。
咱们哺乳动物胚胎的发育过程是复杂且神秘的,是无法用肉眼直接观察的。
在这项研究成果出现之前,也有一些研究胚胎的手段。例如,直接取出不同胎龄的小鼠胚胎观察,以及利用超声或磁共振成像等技术[2.3]。不过这些技术,要么不能研究胚胎的动态发育过程,要么就是隔着一层肚皮分辨率太低。
近几年,有些研究团队开发出了胚胎完全培养基,可以让胚胎在体外培养24-48小时,将胚胎发育动态过程的研究从细胞水平扩展到器官形成早期阶段[4-6]。
然而,虽然科学家在努力模仿子宫内的环境[7],但是随着胚胎的发育,体外无论如何也没有办法模拟胎盘与胎儿之间的营养交换[8],因此在形成各种器官的第9天(E9)之后,研究就无法再进行下去了。
故而,从脐带形成到小鼠出生期间,还没有直接观察胚胎发育细胞水平动态过程的技术手段。
该图片由OpenClipart-Vectors在Pixabay上发布
这个难题在这个跨学科研究团队面前迎刃而解。据了解,黄强副研究员是外科大牛,沈西凌教授在生物工程和活体动物成像领域都颇有建树,而Rudolf Jaenisch教授又是小鼠遗传以及胚胎发育领域的顶级专家。
他们组合在一起的想法就是:在小鼠的腹部开个“腹窗”直接看。这个操作的难度可想而知,毕竟要开腹窗是孕期的小鼠,而且不仅要能看见胚胎的发育,还要尽可能做到对胚胎的发育没有大影响。
最终,他们实现了目标。通过外科手术、生物工程以及3D打印技术,成功给小鼠安装上了腹窗。安装上腹窗的小鼠仍可正常生活,甚至是正常奶娃。
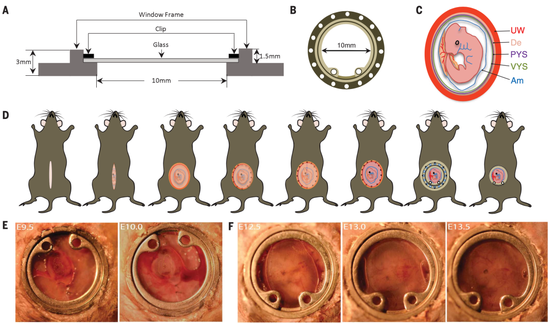
腹窗
他们设计的腹窗是内径为10毫米,深度为1.5毫米的圆形结构,上面有个可移动的玻璃盖玻片,便于对胚胎实施一些操作。
从他们的统计数据来看,如果是在胚胎发育第9.5天植入腹窗,胚胎的存活率约为65.6%;如果在胚胎发育到第12.5天植入腹窗,胚胎存活率可达到80%以上。重要的是,在腹窗下发育出的小鼠,与其他同窝小鼠没有区别,在生长方面也没有异常。

真正的腹窗,可看见胚胎在动
技术平台搭建好之后,研究人员就开始真正意义上的观察研究。
他们首先观察大脑形成早期神经嵴细胞的分化。为了完成这个观察研究,他们使用了Wnt1-Cre-tdTomato转基因小鼠,就是在Wnt1-Cre基因后面加上红色荧光标记基因tdTomato。而Wnt1-Cre基因主要在包括神经嵴细胞(NCC)在内的背神经上皮细胞中表达[9]。
在胚胎发育到11.5(E11.5)天的时候,研究人员用立体显微镜,连续拍摄胚胎6小时。
随后,他们又用双光子显微镜记录下了胚胎脑中tdTomato标记的细胞的成像。在这个研究过程中,他们发现神经嵴细胞可以在E13.5时分化为血管周细胞,以构成大脑的脉管系统。
随后他们又在携带有自噬报告基因的转基因小鼠中发现,在小鼠胚胎发育的第15天(E15),视网膜中就存在自噬体了。
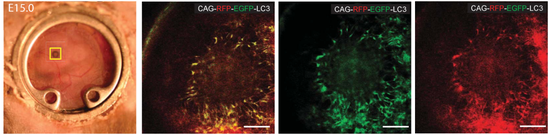
视网膜中的自噬体
用携带钙指示基因的GCaMP6转基因小鼠,在胚胎发育的15.5天(E15.5)观察到神经细胞之间的信号传递。
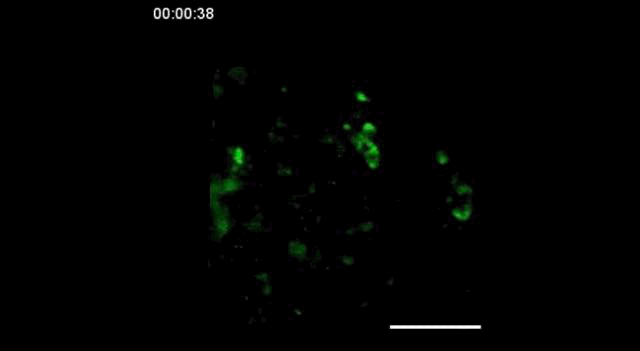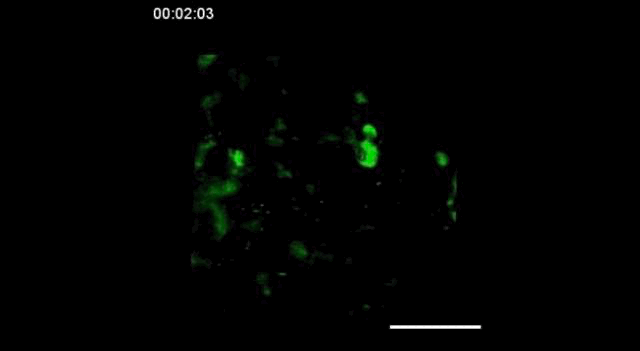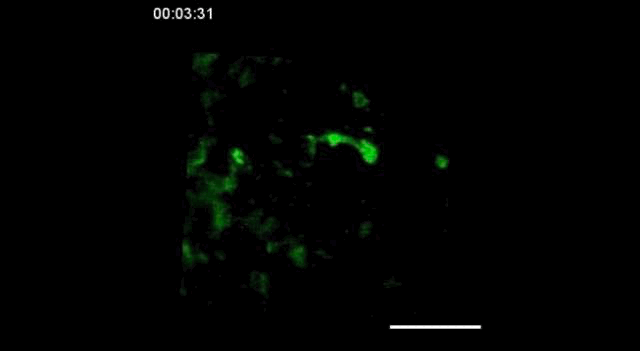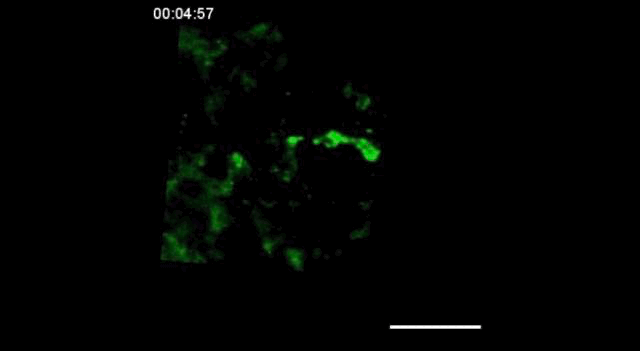
神经信号的传递
胎盘是阻止药物和病原物进入胚胎的屏障[10],那么药物分子和病原物究竟如何通过胎盘,速率又有多快?研究人员用荧光素和腺相关病毒(AAV)分别做了研究。
荧光素在静脉注射后1.5分钟会通过脐带,并在注射后30分钟扩散到整个胚胎中。
腺相关病毒是一种重要的治疗病毒载体,目前还没有腺相关病毒渗透胎盘并在胚胎中表达外源基因的动力学相关研究。
研究人员在胚胎发育到11.5天(E11.5)的时候,通过母鼠尾部静脉,将携带绿色荧光蛋白或红色荧光蛋白的腺相关病毒载体注射到母鼠体内。他们发现,在注射72小时之后,也就是胚胎的第14.5天(E14.5)观察到胚胎中有绿色荧光蛋白表达,但是红色荧光蛋白的表达稍微滞后。
研究人员认为,这个研究表明,AAV载体在活体成像中也有一定的用途,不过不同的载体可能有不同的传递动力学。
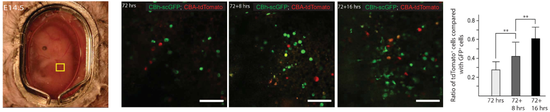
腺相关病毒在胚胎中的扩散
接下来,研究人员将这项技术与子宫内电转技术结合,在大脑中标记了特定细胞,还观察到了细胞分裂及迁移。
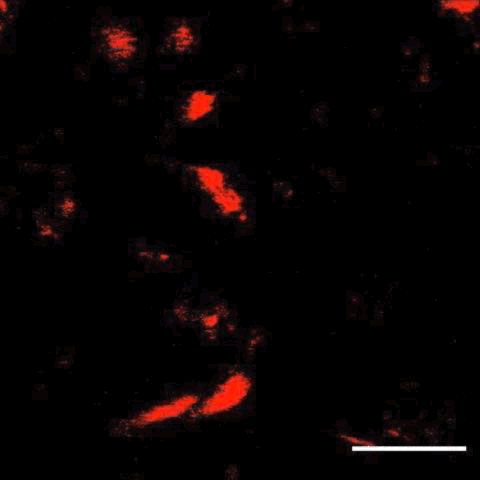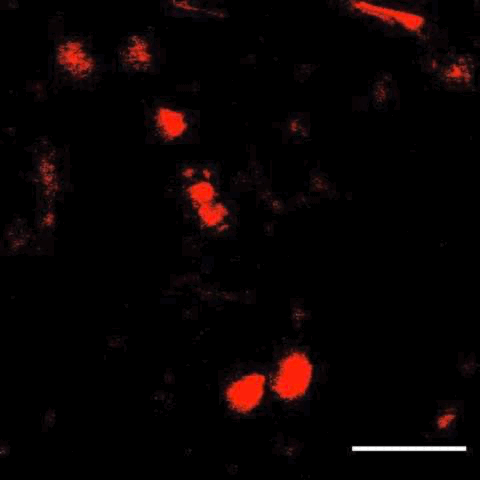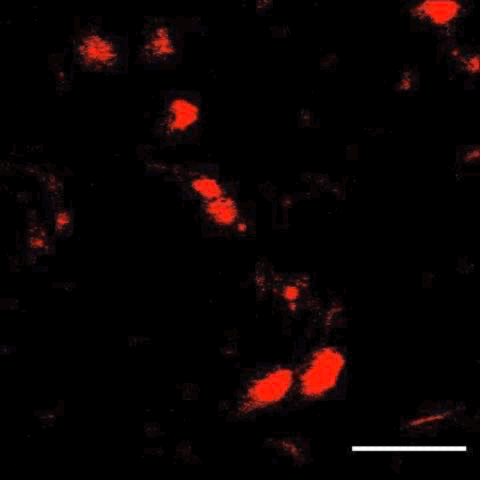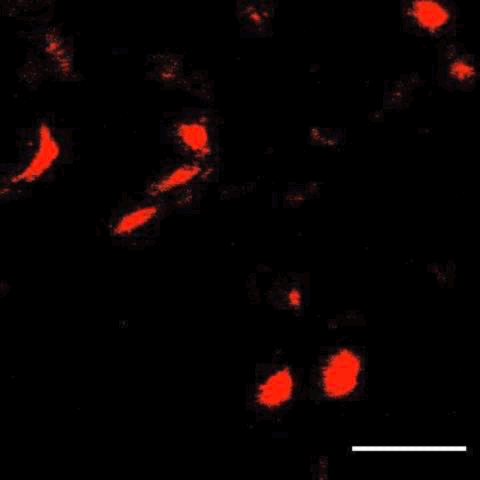
细胞分裂
最后,研究人员将外源多能干细胞衍生的、绿色荧光蛋白标记的人神经嵴细胞,和红色荧光蛋白标记的鼠神经嵴细胞,同时注射到发育到8.5天(E8.5)的胚胎里,在胚胎发育到14.5天(E14.5)时使用立体显微镜成像,以比较人神经嵴细胞和鼠神经嵴细胞在单个宿主胚胎中的整合情况。
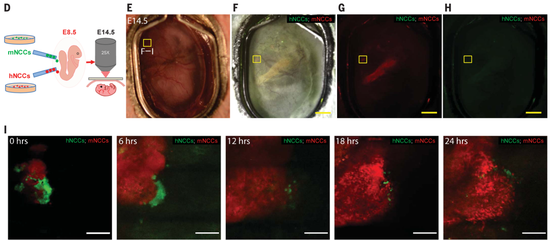
注射人神经嵴细胞和鼠神经嵴细胞的嵌合胚胎发育
总的来说,研究人员认为[11],“这项研究实现了直视下观察哺乳动物胚胎发育、以高分辨成像活体观察胚胎发育的动态过程,有助于研究早期器官形成过程中不同干细胞的命运决定,并进行细胞谱系分析。结合其他生物医学技术,可以修饰、编辑胚胎发育中的特定细胞并研究该细胞的生物学特性,为基因治疗提供了一个研究模型。”
最后,用一句话总结一下我的感受:“太震撼了”。
参考资料:
[1].https://science.sciencemag.org/content/368/6487/181
[2].Cristofano A D, Pesce B, Cordon-Cardo C, et al. Pten is essential for embryonic development and tumour suppression[J]. Nature genetics, 1998. 19(4): 348-355.
[3].Gregg C L, Butcher J T. Quantitative in vivo imaging of embryonic development: opportunities and challenges[J]. Differentiation, 2012. 84(1): 149-162.
[4].Pantazis P, Supatto W. Advances in whole-embryo imaging: a quantitative transition is underway[J]. Nature Reviews Molecular Cell Biology, 2014. 15(5): 327-339.
[5].McDole K, Guignard L, Amat F, et al. In toto imaging and reconstruction of post-implantation mouse development at the single-cell level[J]. Cell, 2018. 175(3): 859-876. e33.
[6].Muñoz W A, Trainor P A. Mouse Embryo Culture for the Study of Neural Crest Cells[M]//Neural Crest Cells. Humana Press, New York, NY, 2019: 107-119.
[7].Shahbazi M N, Zernicka-Goetz M. Deconstructing and reconstructing the mouse and human early embryo[J]. Nature cell biology, 2018. 20(8): 878-887.
[8].Cao J, Spielmann M, Qiu X, et al. The single-cell transcriptional landscape of mammalian organogenesis[J]. Nature, 2019. 566(7745): 496-502.
[9].McMahon A P, Joyner A L, Bradley A, et al. The midbrain-hindbrain phenotype of Wnt-1− Wnt-1− mice results from stepwise deletion of engrailed-expressing cells by 9.5 days postcoitum[J]. Cell, 1992. 69(4): 581-595.
[10].Leong H S, Steinmetz N F, Ablack A, et al. Intravital imaging of embryonic and tumor neovasculature using viral nanoparticles[J]. Nature protocols, 2010. 5(8): 1406.
[11].http://news.xjtu.edu.cn/info/1004/132844.htm
|


